パーキンソン病とは?
神経伝達物質であるドパミンの不足により、脳→筋肉に伝わる指令を上手く伝えられず、振戦や固縮などの運動障害を生じる進行性の疾患。
自律神経や中枢神経の病変により、自律神経障害(便秘や起立性低血圧など)や精神障害を伴うこともある。
パーキンソン病の特徴
- 完治することのない進行性の疾患
- 発症年齢は40才以上に多く、高齢になるほど発症率が増加する
- 頻度が高い神経疾患で、1000人に1.5人、60才以上では100人に1人が発病。
- 全国の患者数は20万人と推定されている
- 女性の方が男性より1.5~2倍多い傾向
- 難病(特定疾患)に指定されている
パーキンソン病の原因
パーキンソン病は、原因により、孤発性(こはつせい)と家族性に分類される。
孤発性パーキンソン病
原因は特定できないが、遺伝的要因や環境要因などいくつかの要因が重なり、発症すると考えられている。
環境要因のひとつとして、過度な交感神経の緊張(ストレス)が関与すると言われている。
パーキンソン病の90%以上は、この孤発性(いわば原因不明)に分類される。
家族性パーキンソン病
パーキンソン病の5~10%は、家族性(血縁者)に発症がみられ、遺伝子が関与していると考えられている。
一部の遺伝子異常は発見されているが、いくつかの遺伝子異常や環境要因などの組み合わせによって発症していることも考えられる。
パーキンソン病の病態
ドパミン作動性神経細胞の変性
パーキンソン病は、中脳の黒質緻密部(こくしつちみつぶ)にあるドパミン作動性神経細胞が変性・脱落する。この神経細胞は、メラニン色素をもっているため、変性・脱落により色が淡く変色する。

発症時には、このドパミン作動性神経細胞の80%が脱落(壊死)していると言われている。
なぜドパミン作動性神経細胞が減少するかは明らかになっていない。
ドパミンの産出が低下
ドパミン作動性神経細胞が減少することで、神経伝達物質のひとつであるドパミンの産出が低下する。
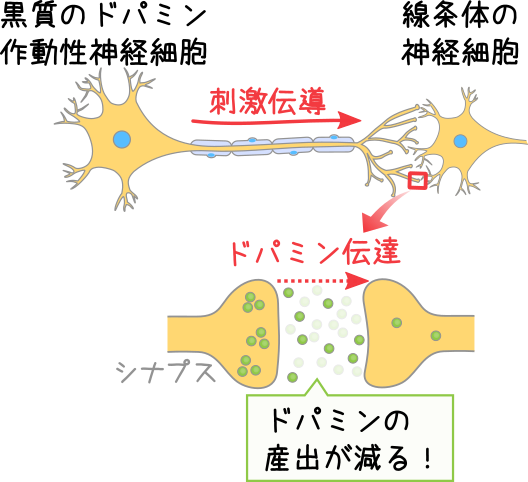
ドパミンは、主に運動機能をつかさどる線条体へ送られて、運動の調整のほか、快楽の感情、記憶、学習に関与する。
したがって、ドパミンが減少することで、 運動障害、記憶力の低下、意欲・集中力・注意力の低下などを引き起こす。
相対的に、アセチルコリンの分泌が増加
神経伝達物質は、他の神経伝達物質とバランスをとり合う性質がある。
運動機能は、中枢(脳)の分泌されるドパミンと、運動神経末端から放出されるアセチルコリンのバランスをとることで、細かい運動を調整している。
つまり、ドパミンが減少すると、相対的にアセチルコリンの放出が過剰となり、運動障害を悪化させる結果となる。
レビー小体の発生
パーキンソン病は、脱落した中脳黒質の神経細胞に「レビー小体」という異常なたんぱく質が出現する。
レビー小体が存在する病態は、レビー小体型認知症を含めて「レビー小体病」と呼ばていて、パーキンソン症状(パーキンソニズム)・幻覚・日内変動が特徴的な症状として現れる。
パーキンソン発症後、数年後にに認知症が現れたときには『認知症を伴うパーキンソン病(PDD)』と呼ばれ、それ以前に認知症が現れた場合には『レビー小体型認知症(DLB)』と区別される。
パーキンソン病の症状
四大症状
安静時振戦
椅子に座っていたり、横になっている安静時にのみ手足が震える症状。
動作を開始すると、振戦は消失する。
左右非対称性(左右どちらかに)に出現するのが特徴。

固縮
関節を他動的に動かすと、歯車のようにガクガクとぎこちない動きになる。

無動
すべての動作が遅くなってしまう症状。動き始めるまでに時間がかかるため、歩き始めの1歩が出なかったり、寝返りが打てなくなる。
姿勢反射障害
頭部を前方に突き出す前傾姿勢をとる。また、バランスが崩れた時の防御反射(手や足でバランスを取ろうとする反応)が消失するため、転倒しやすくなる。
患者の肩を持って、後ろに瞬間的に引く『Pull test』を行うと、足が後ろにでずに転倒したり、小走りになる反応がみられる。

その他の運動障害
- 仮面様顔貌
能面のように表情がない顔貌 - 歩行障害
すくみ足・小刻み歩行・突進歩行など - 小声
- 小字症
その名の通り、書く字が小さくなる - 嚥下障害
- 流涎(りゅうぜん)
よだれを垂れ流すこと
自律神経障害
ドーパミンの分泌が低下することで、自律神経系の神経伝達物質であるアセチルコリンやノルアドレナリンのバランスも崩れる。また、自律神経系にレビー小体病変が現れることでも自律神経障害を生じる。
- 便秘
※約8割の患者にみられる - 起立性低血圧
それに伴う失神 - 排尿困難・残尿
- 発汗障害
- 睡眠障害など
精神障害
精神障害は、神経伝達物質であるドパミンやセロトニン、ノルアドレナリンの減少が関係していると言われている。
また、認知機能障害や幻覚は、大脳皮質などに広がるレビー小体にも関係する。
- 無関心
- 抑うつ
40%の患者にみられる - 不安
- 認知症
20~30%の患者にみられる - 幻覚・妄想
パーキンソン病の進行と重症度
パーキンソン病は、完治することのできない進行性の疾患だが、その進行はゆっくりで、発症後10年程は自立した生活が送れことが多い。
その後は日常生活動作に介助が必要となることが多いため、患者のQOLや治療の調整のために、症状の進行度(重症度)を評価することが重要となる。
評価には、ホーン・ヤール(Hoehn-Yahr)分類が広く用いられ、ステージⅠ~Ⅴの5段階に分けて評価する。
| stage | ホーン・ヤール分類 | 生活機能障害度 |
|---|---|---|
| Ⅰ | 症状は一側性で、機能障害はないか、あっても軽度 | Ⅰ度 日常生活、通院にはほどんど介助を要さない |
| Ⅱ | 両側性の障害があるが、姿勢保持の障害はない。日常生活、職業には多少の障害はあるが行える | |
| Ⅲ | 明らかな姿勢反射障害(突進歩行)があり、活動は制限されるが、自力での生活は可能 | Ⅱ度 日常生活、通院に介助を要する |
| Ⅳ | 重篤な機能障害を呈し、自力での生活は困難となるが、まだ支えられずに立つことや歩くことはどうにか可能 | |
| Ⅴ | 立つことも不可能で、介助なしではベットまたは車椅子での生活となる | Ⅲ度 日常生活に全面的な介助を要し、歩行起立不能 |
パーキンソン病の検査・診断
パーキンソン病の診断は、同じような症状を示すパーキンソン症候群との鑑別が重要となる。
パーキンソン症候群とは?
パーキンソン病以外で、パーキンソン症状を示す疾患の総称。
脳血管障害、薬物、認知症のほか、線条体黒質変性症や進行性核上性麻痺などの難病などがあげられる。
問診
パーキンソン病の4大徴候のうち2つ以上の神経所見があるか確認する。
- 安静時振戦
- 筋固縮
- 無動
- 姿勢反射異常
感染・薬物・中毒のチェック
パーキンソン症状を引き起こす、感染を起こしていないか、薬物・毒物への暴露はないか確認を行う。
頭部CT・MRI
脳血管障害などの異常を認めないか確認する。
近年では、ニューロメラニン強調画像・磁化率強調画像といった特殊なMRI検査で、黒質の神経細胞の減少や変化を見ることができるため、パーキンソン症候群との鑑別に有効とされている。
抗パーキンソン病薬の投与
抗パーキンソン病薬であるレボドパ(L-dopa)やアゴニストに対する反応をみる。
パーキンソン病であれば、症状の改善がみられる。
MIBG心筋シンチグラフィー
MIBG(メタヨードベンジルグアニジン)という物質は、交感神経終末から放出される神経伝達物質ノルアドレナリンと同様に、貯蔵・放出される性質をもつ。
パーキンソン病では、このMIBGの心筋への取り込み(集積)が低下するため、ガンマカメラで撮影しながら、その状態を確認する。
パーキンソン病の治療
パーキンソン病の治療は、薬物療法が基本だが、薬物療法でコントロール困難な場合は、手術療法が適応となることがある。
薬物療法
レボドパ
パーキンソン病治療の中心的な薬のひとつ。
ドーパミンの前駆物質であるレボドパを投与することで、不足したドーパミンを補充することができる。
ただし、レボドパを分解する酵素は、脳以外にも存在するため、脳へ到達する前にほとんどが分解されてしまう。
そこで、脳以外でのレボドパ分解を抑制する薬を配合しているドパミン製剤がある(レボドパ・カルビドパ合剤やレボドパ・ベンセラジド合剤)。
レボドパは内服後、すぐに効果が現れ、ほぼすべての患者へ効果が期待できるが、作用時間が1時間強と短い。
商品名:ドパストン、ドパゾール
副作用:ジスキネジア・wearing-off(ウェアリング・オフ)現象、on-off(オン・オフ)現象、悪心・嘔吐、幻覚・妄想
wearing-off現象とは?
レボドパの効果が持続しなくなり、次の服用時間よりも前に、症状が出てしまう現象のこと。長期的に内服を継続した患者の半数以下にみられる。
on-off現象とは?
薬の内服時間に関係なく、突然スイッチが切れたように症状が現れたり、逆にスイッチが入ったかのように症状が消失する現象。長期的に内服を継続した患者の数十%にみられる。
ドパミン受容体刺激薬(アゴニスト)
ドパミン受容体に、ドパミンが放出されたときと同じような刺激を与えることで、作用を補うことができる。
レボドパより作用時間が長く、1日1回の内服で効果が持続する薬もある。また、ジスキネジアやウェアリング・オフ現象などの副作用も少ない。
商品名:<非麦角系>ビ・シフロール・レキップ<麦角アルカロイド>パーロデル・ペルマックス・カバサールなど
副作用:嘔気・嘔吐(30%の患者にみられる)、幻覚・妄想、心臓弁膜症(麦角系のみ)、突発的睡眠(非麦角系のみ)など
MAO-B阻害薬
脳内でドパミンを分解するMAO-B(モノアミン酸化酵素B)の働きを阻害することで、ドパミンの放出量を増やす薬。
レボドパと併用することで、レボドパの効果を高めることができ、ウェアリング・オフ現象の改善を図ることができる。
商品名:<セレギニン>エフピー
副作用:レボドパの副作用発現頻度の増加
アマンタジン塩酸塩
脳内のドパミン放出を促進させる薬。
A型インフルエンザウイルの抗ウイルス薬としても用いられる。
商品名:シンメトレル
副作用:幻覚・せん妄
抗コリン薬
ドパミン不足により、相対的に増強するアセチルコリンの作用を抑制する薬。
振戦の改善目的で投与されることがあるが、知的機能を低下を招く恐れがあるため、使用頻度は少ない。
商品名:アーテン、アキネトン、トリモール、パーキン
副作用:口渇、便秘、排尿障害、眼調整障害(目のかすみ)、物忘れなど
COMT阻害薬
レボドパを分解するCOMT(カテコール-O-メチル転移酵素)の働きを抑えることで、脳に到達するレボドパ量を増やす薬。
レボドパと同時に服用することで、レボドパの効果を高めることができる。
商品名:コムタン
副作用:レボドパの副作用、不眠症、突発的睡眠、幻覚、着色尿など
ゾニサミド
てんかんの治療薬だったが、ドパミン合成の促進や、ドパミンを分解する酵素MAO-Bの働きを阻害する働きがあることがわかり、パーキンソン病の治療薬として用いられる。
商品名:トレリーフ
副作用:眠気、嘔気、発汗減少など
定位脳手術
薬物療法でコントロール困難な例は、局所麻酔下で定位脳手術が行われることがある。
脳の異常部に電極を挿入して熱凝固させる『破壊術』と、脳に留置したリード(電極)と前胸部の皮下に埋め込んだパルス発生器を繋ぎ、神経刺激を流す『脳深部刺激療法(DBS)』(←脳のペースメーカーのようなもの)がある。

いずれもパーキンソン症状の改善を期待できるが、DBSは、副作用が少なく、両側に埋め込めること、刺激を体外から調整できるというメリットがあり、現在主流となっている。

