心筋梗塞とは?
冠動脈血流の急激な減少により、心筋壊死をきたした状態。
心筋梗塞の病態生理
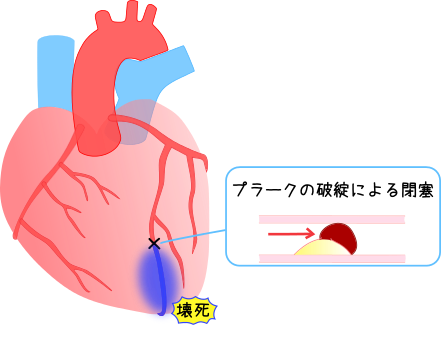
動脈硬化の原因となるプラークが破綻し、血栓が形成されることで冠動脈の血流が途絶え、閉塞部より末梢の心筋に壊死を来たす。
壊死した心筋の範囲により、非ST上昇型心筋梗塞(NSTEMI:ノンステミ/エヌステミと読む)とST上昇型心筋梗塞(STEMI:ステミと読む)に分類される。
NSTEMIは、心内膜下の壊死にとどまり、STEMIは心筋全層の壊死を来たした状態でありSTEMIの方が緊急性が高く、治療方針も異なる。

心筋梗塞の症状
- 30分以上続く強い胸痛
- 胸部全体、背部、心窩部の痛み
※左前腕・肩、首、歯の痛みを訴えることもある - 胸部不快感や息切れを主訴とすることもある
- ショック症状
- 迷走神経反射(徐脈・血圧低下)
- 嘔気・嘔吐
心筋梗塞の検査所見
心電図の変化
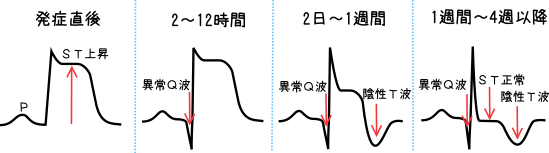
心電図は急性心筋梗塞の診断に最も有効で、おかしいなとおもったらすぐに12誘導心電図で検査し、5~10分おきに評価する。
ほとんどは、障害電流を示すST上昇を呈し、発症2~6時間後には心筋の壊死を示す異常Q波、2~3日後には陰性T波など経時的にに心電図も変化する。壊死した心筋は治ることはないため、一度でも心筋梗塞を起こした患者は異常Q波形が消失することはない。
※NSTEMIの場合には狭心症と同じように障害電流を示すためSTは低下し、異常Q波はみられない。
血液検査データ
| 心筋障害マーカー | ||
|---|---|---|
| CK-MB | 心筋に多く存在する蛋白 | ↑ |
| トロポニンT | 心筋に特異的に存在する蛋白 | ↑ |
| ミオグロビン | 心筋や骨格筋に存在する蛋白 | ↑ |
| H-FABP | 心筋に特異的に存在する蛋白 | ↑ |
心筋内に存在するこれらの蛋白が、心筋障害時には血液中に漏れ出し、値が上昇する。そのため、心筋梗塞が疑われる場合には、これらの心筋障害マーカーをチェックし、心筋障害の有無を確認する。
特に、トロポニンTやH-FABP(ヒト心臓由来脂肪結合蛋白:ラピチェックと呼ばれる。)は心筋に特異的に存在している蛋白のため、確定診断をすることができる。また、H-FABPは1~2時間で上昇をみとめるため、早急な診断が可能となる。ただし、H-FABPは偽陽性となることもあるのでトロポニンTの結果を待ったほうが確実。
この他にも発症2~3時間後に白血球、12時間程度でAST、ALT、24時間以降にはCRPの上昇などの血液データの変化がみられる。
部レントゲン
心不全の度合いにより、心拡大・肺うっ血・肺水腫・胸水の貯留がみられることもある。
心エコー
心電図で心筋梗塞が否定的な場合にも、壁運動異常asynergyや左室駆出率EF、虚血範囲の評価を行うことが可能。
また、心内膜液の貯留や心室内血栓、僧房弁逆流など心筋梗塞に合併する病態を発見することも可能となる。
→『心エコー結果の見方』を見る
心筋梗塞の治療
初期治療はMONAモナ
心電図でST上昇型心筋梗塞STEMIとわかったら、初期治療としてMONA(モルヒネ、酸素、硝酸薬、アスピリン)を投与する。
MONA
M:塩酸モルヒネやそのほか鎮痛剤の静注
O:鼻腔カニューレ2~3Lの酸素投与 ※ショック時は100%酸素投与
N:硝酸薬舌下投与orスプレーor静注
A:アスピリン咀嚼服用
鎮痛剤は、強い痛みによる苦痛を緩和するため、強い苦痛により心負荷も増大してしまうため、心負荷を増悪させないためにもに用いられる。
酸素は、低酸素血症は不整脈や心筋虚血を増悪させるため自覚症状がなくても必ず投与する。
硝酸薬の内服は、狭心症との鑑別や、前負荷・後負荷の軽減を目的に使用されるが、血管拡張により低血圧を引き起こすため、普段の血圧より40~50mmHg以下、収縮期血圧90mmHg以下の場合には使用禁忌。
アスピリンは血小板凝集の抑制のために使用される。こちらは副作用として出血傾向があるため、脳出血や心破裂などのリスクがある場合、十分に注意が必要となる。
再灌流療法
STEMIの場合には、血栓により血流が遮断されたことにより心筋壊死を最小限にとどめる目的で再灌流療法が行われる。
NSTEMIの場合には、まずCAG(冠動脈造影)をして、適応があれば次の再灌流療法を行う。
PCI
狭窄部にしてステントやバルーンなどさまざまなデバイスを挿入し、血管内腔を広げて血管の形成と再灌流を行う治療法。
CABG
冠動脈バイパス術。LMT病変や3枝病変などPCIでは治療困難な場合には開胸手術適応となる。
内胸動脈、大伏在静脈、右胃大綱動脈をバイパスとして、冠動脈の狭窄部よりも末梢と大動脈をつなぎ、末梢血流を確保する。
薬物治療
βブロッカー
交感神経のβ受容体の働きを遮断し、心臓の働きを抑えることで、心筋の酸素消費量を減らすことができる。
硝酸薬
冠動脈を拡張させる他、末梢の血管も拡張させるため、前負荷・後負荷ともに軽減することができる。
カルシウム拮抗薬
あらゆる筋肉を動かすカルシウム。血管の筋肉(平滑筋)にも作用し、血管を収縮させるため、Caの作用を遮断することで血管拡張を促す。
抗血小板薬
抗血小板薬心筋梗塞の原因である、アテローム血栓ができるのを防ぐ。
PCIの治療をした場合には、治療後継続的に内服することとなる。
心筋梗塞の合併症
心不全
梗塞部位や心筋壊死の範囲により、十分な心拍出量がえられず、心不全となることがある。また、心拍出量の低下から心原性ショックをきたすと急性死亡の原因となりうる。
不整脈
心筋梗塞発症後の不整脈の発生率は高く、一部は致死性の不整脈に移行し死に至る一番多く、一番恐ろしい合併症。
1、VF
VFを合併すると、突然死に至ることが多い。
特に前壁中隔梗塞で発生しやすい。心不全はショックを伴う場合には4時間以内、心不全やショックを伴わない場合には発症12時間以降に出現するとされている。
2、VT
血行動態が不安定なものが多く、頻回に除細動での治療が必要となり、VFと合併する場合も多い。
3、房室ブロック
房室結節を血流する右冠動脈の閉塞(下壁梗塞)で主に発生する。
Ⅰ度~Ⅲ度まで出現するが、一過性に経過することが多い。
心破裂
心筋が壊死することで、心臓が血圧に耐えられる外壁が破裂し、失血と心タンポナーデから死に至る、救命率が極めて低い合併症。
心破裂はSTEMIの1~6%に合併し、発症24時間以内と、3~5日の晩期に発症のピークがある。
初回の心筋梗塞、前壁梗塞、高齢者、特に女性に多く、側副血行路、ステロイド剤の使用、血栓溶解療法が危険因子となる。
乳頭筋断裂による僧房弁閉鎖不全
僧房弁の開閉に関与している乳頭筋。
発症後数日で起こることが多く、広範囲の下壁・後壁の梗塞が、乳頭筋まで及ぶことで筋が切れてしまい機能しなくなる。そうすると僧房弁の逆流がおき、血液が十分に送り出せない心不全の状態となる。CABGのほか、僧房弁置換術が必要となることもある。

